Beta-amyloide plaques
Sammenhængen mellem mængden af plaques og Alzheimers sygdom er langt fra entydig. Nogle ældre personer udvikler en vis mængde plaques i hjernevævet uden at udvise tegn på sygdom. Andre ældre har kliniske symptomer på Alzheimers sygdom, uden at der kan påvises forhøjede mængder af plaques i deres hjerner.
Det er også uklart, om det er selve de amyloide plaques, der forårsager Alzheimers sygdom, eller om de snarere udgør et biprodukt til sygdomsprocessen. Ved tidligt indsættende, arvelige varianter af Alzheimers sygdom menes genetiske mutationer at bidrage til øget dannelse af beta-amyloid.
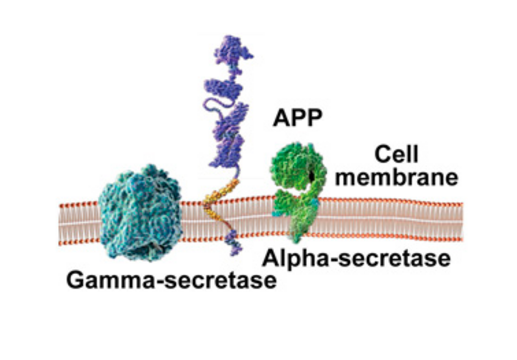
Udgangspunktet for amyloide plaques er amyloid precursor proteinet (APP), der er ét ud af mange proteiner forbundet med cellemembranen – den barriere, der omslutter cellen. APP dannes inde i cellen og sidder forankret i membranen.
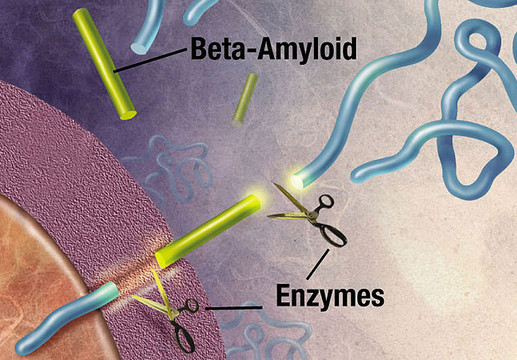
Særlige enzymer klipper eller spalter APP op i mindre stumper. Enzymerne, der blev identificeret i 1999 og 2000, kaldes henholdsvis alpha-, beta- og gammasekretase. Forarbejdningen af APP kan følge to forskellige udviklingsretninger, afhængigt af hvilket enzym, der er involveret, og i hvilken del af APP'et, spaltningen foregår. Dette har vidt forskellige konsekvenser.
Alpha-sekretase
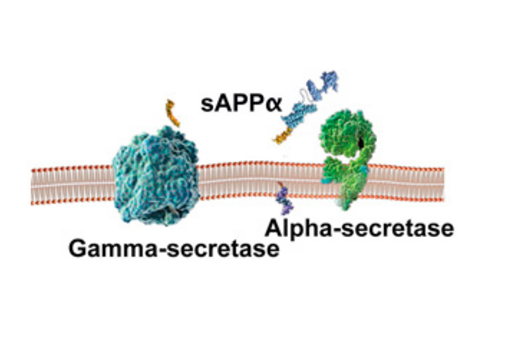
I den godartede udviklingsforløb (pathway) spalter alphasekretase APP-molekylet indenfor det område, der har mulighed for at blive til beta-amyloid. Herved umuliggøres dannelsen af beta-amyloid peptidet og dannelsen af plaques.
Ved spaltningen frigøres et fragment kaldet sAPP fra neuronet, der menes at have gavnlige egenskaber så som at fremme neuronal vækst og overlevelse. Resten af APP-fragmentet, der sidder fast i cellemembranen, spaltes derpå af gammasekretase ved enden af beta-amyloid segmentet.
Det mindste af fragmenterne er et peptid på 40 aminosyrer (Aβ-40), der også udfældes til mellemrummet udenfor neuronerne. Det største fragment forbliver inde i neuronet og vekselvirker med faktorer i cellekernen.
Betasekretase
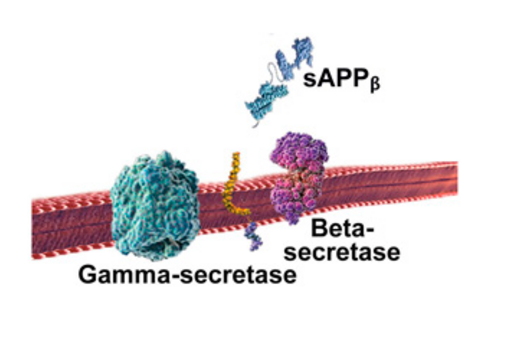
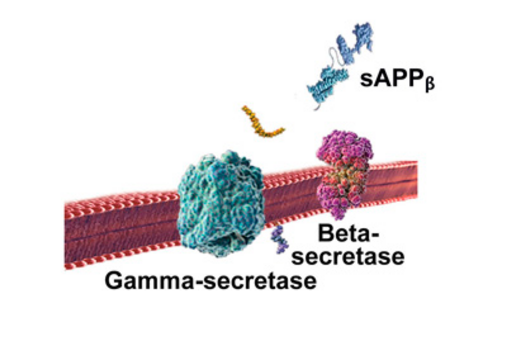
I det skadelige udviklingsforløb spalter betasekretase først APP-molekylet ved den ene ende af beta-amyloid peptidet, hvorved sAPPβ udskilles fra cellen (figur 3).
Herefter afklipper gammasekretase det tilbageblevne APP-fragment, der stadig sidder fast i cellemembranen, ved den anden ende af beta-amyloid peptidet. Efter at være blevet klippet af i begge ender, udfældes beta-amyloid peptidet til mellemrummet udenfor neuronerne og klæber efterhånden sammen med andre beta-amyloid peptider.
Dette peptid er i modsætning til den uskadelige Aβ-40 variant på 42 aminosyrer (Aβ-42) (figur 4). Disse små, opløselige ophobninger af to, tre, fire eller op til et dusin Aβ-42 peptider kaldes oligomerer. Oligomerer i bestemte størrelser menes at reagere med receptorer på naboceller og synapser og påvirker deres funktionsevne.
Nogle af oligomererne udskilles sandsynligvis fra hjernen. Men de, der ikke kan udskilles, klumper sig sammen med flere Aβ-42 peptider.
Efterhånden vokser oligomererne sig større og bliver til såkaldte protofibriller og fibriller. Lidt efter lidt tilføjes andre proteiner og overskydende cellemateriale, og disse stadigt mere uopløselige ansamlinger kombineres og bliver til plaques, der er karakteristiske for Alzheimers sygdom.
Man har mistænkt, at plaques var årsag til den ødelæggelse af neuronerne, der ses ved Alzheimers sygdom. Men meget tyder efterhånden på, at oligomererne måske udgør det største problem. Dannelsen af plaques er måske udtryk for et sidste forsøg fra hjernens side på at holde det skadelige Aβ-42 væk fra neuronerne.