Kan man reparere en hjerne?

Rigtig mange mennesker verden over venter på, at der kommer behandling, som kan kurere demenssygdomme. Selvom der har været lovende kliniske forsøgsbehandlinger, er der i dag ingen tilgængelig helbredende medicin, men måske er en anden løsning på vej.
I kælderen under Nationalt Videnscenter for Demens på Rigshospitalet står en række store frysere med temperaturer på -180°C. Her opbevares blandt andet stamceller fra patienter med demens fra centrets hukommelsesklinik, hvor de kommer for at blive udredt og fulgt under deres sygdom. Nogle af disse patienter deltager i forskningsprojekter, hvor der bliver taget en hudbiopsi.
Fra hudcelle til stamcelle til nervecelle
Stamcellerne i videnscentrets store frysere bliver dannet fra disse hudbiopsier fra patienterne. Hudbiopsierne danner hudceller, som deler sig, hvorefter forskerne omdanner hudcellerne til stamceller ved at ændre på genprofilen. Stamcellerne kan blive til alle kroppens celler, og på laboratoriet i Nationalt Videncenter for Demens omdanner forskerne dem til forskellige slags hjerneceller, herunder neuroner.
”I laboratoriet omdanner vi stamceller til neuroner, der svarer til dem, mennesker har i hjernen. For at få stamcellerne til at blive til hjerneceller, tilsætter vi nogle af de samme biokemiske stoffer, som man har i hjernen. Det giver signal til stamcellerne om, at de skal blive til hjerneceller,” forklarer seniorforsker Patrick Ejlerskov, og fortsætter:
”Vi kan både danne 2D neuronkulturer og 3D hjerneorganoider, også kaldet ’minihjerner’, hvor sidstnævnte bedre repræsenterer hjernens komplekse 3D organisering. Disse cellulære modeller er helt unikke for den enkelte patient, da de indeholder det samme genetiske materiale som patienten selv. De cellulære defekter, som medfører, at en patient har kognitive problemer, vil derfor afspejle sig i de laboratoriefremstillede neuroner og 3D minihjerner. Det giver os mulighed for at studere de molekylære mekanismer i demenssygdommene samt udføre behandlingsforsøg, som påvirker disse cellemekanismer i gunstig retning."
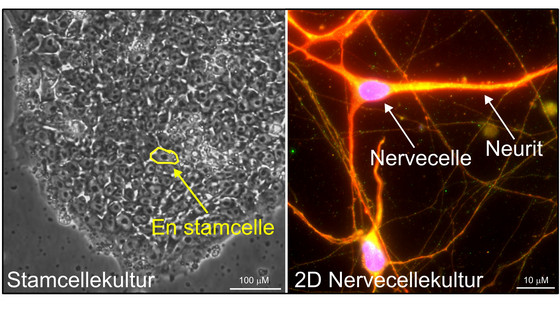
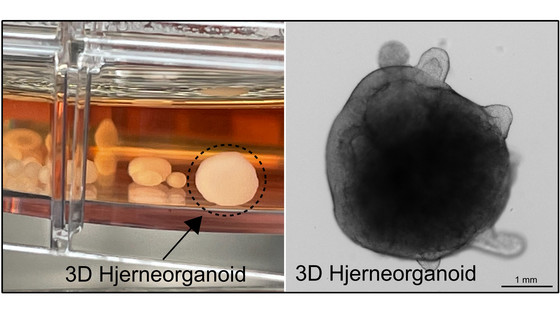
Som eksempel nævner Patrick Ejlerskov, at der i alle kroppens celler dannes affald, som det såkaldte autofagisystem renser bort. Autofagi betyder ’selvspisende’ og betegner en proces i cellerne, hvor celleaffaldet nedbrydes ved hjælp af enzymer. Autofagisystemet kan også nedbryde invaderende celler, såkaldte patogener, såsom bakterier og virus.
”Man ved, at autofagisystemet er blokeret ved demenssygdomme og dermed ikke formår at rense cellerne for al affaldet. Konsekvensen er, at der ophobes skadeligt protein, der ødelægger hjernecellerne og over tid fører til demenssygdom. Ved at tænde for autofagisystemet med forskellige farmakologiske stoffer i vores patient-cellemodeller, undersøger vi, om det kan reducere de cellulære defekter, der medfører demenssygdom,” siger Patrick Ejlerskov.
I laboratoriets mikroskoper kan man se, at hjernecellerne har lange ’arme’, som forbinder de mange nerveceller. Armene, der kaldes neuritter, danner et omfattende neuralt netværk, som nervecellerne bruger til at signalere til hinanden. Det vil sige, at hjernecellerne kan kommunikere med hinanden og viderebringe vigtige signaler i forhold til biologiske funktioner og responser.
Når man har en demenssygdom, mister man en masse hjerneceller, hvilket kan ses på skanninger af en syg hjerne. Tabet af de mange hjerneceller medfører, at kommunikationen i hjernen bliver påvirket, særligt i de områder, der styrer hukommelsen. Men hvis man kan erstatte de tabte hjerneceller med nye, vil man i princippet kunne reparere hjerner med demens. Så forskningen handler kort sagt om at erstatte de hjerneceller, patienterne har mistet. De nye hjerneceller vil etablere forbindelser til andre hjerneceller og genoprette den beskadigede kommunikation i hjernen.
”Der foregår på nuværende tidspunkt kliniske tests af stamcellebehandling i patienter med Parkinsons sygdom, som er et meget interessant samarbejde mellem Københavns Universitet, Lund Universitet og Novo Nordisk. Hvis disse forsøg, som vi følger meget tæt, viser gavnlige effekter, vil det bane vejen for celle-baserede behandlinger i hjernen,” fortæller Patrick Ejlerskov.
Klipper det syge gen ud
Når man behandler en patient med vedkommendes egne stamceller, er der mindre risiko for afstødning, som man kan se ved fx organtransplantation, hvor organet kommer fra et andet menneske. I stamcellerne fra patienter med familiær nedarvet demens kan forskerne ’klippe’ det muterede og sygdomsfremkaldende gen ud af cellens genmateriale og erstatte det med et raskt gen. Disse stamceller er dermed kureret for sygdommen. Denne teknik kaldes geneditering og er en ideel metode at anvende til de arvelige demenssygdomme.
Ved at injicere de ’kurerede’ stamceller i de områder i hjernen, hvor der er tab af hjerneceller, kan de syge neuroner gradvist erstattes med raske.
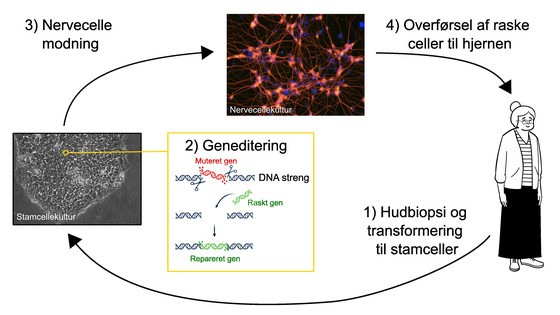
”Det er dog en vanskelig opgave med mange udfordringer, da der skal mange celler til, og fordi cellerne skal integreres i de rigtige hjerneområder. Det er også vigtigt, at alle de celler, der integreres i hjernen, bliver til neuroner, som ikke deler sig. Denne lovende behandlingsform er stadig i sin vorden, så det ligger et stykke ude i fremtiden, før vi vil kunne tilbyde en eventuel celle-baseret behandling til patienter med demens og andre neurodegenerative sygdomme,” slutter Patrick Ejlerskov.
Læs også de andre artikler i miniuniverset

Hvis du selv eller en pårørende har en demenssygdom, så besøg Alzheimerforeningens hjemmeside og se deres tilbud og aktiviteter.